Questo termine, “prolasso della valvola mitrale”, è diventato molto noto da quando la diffusione dell’ecocardiografia ha permesso di scoprire in moltissime persone (circa il 20% della popolazione “normale”) le fasi iniziali di questa anomalia, che può costituire un processo evolutivo, più che una situazione stabile e definitiva.
A seguito di una alterazione genetica (mutazione dei geni che compongono i cromosomi, corpuscoli presenti nelle nostre cellule, derivati per metà dalla madre e l’altra metà dal padre, che stabiliscono tutte le nostre caratteristiche corporee, dal colore dei capelli alla robustezza delle valvole cardiache) la composizione del tessuto connettivo è alterata, rendendolo meno resistente alle sollecitazioni meccaniche (stress).
 Il
tessuto connettivo è la rete
di sottili filamenti (fibrille) che fa da impalcatura a tutto il nostro
corpo (figura 1). Infatti, a seconda degli
organi, la rete di tessuto connettivo, presente ovunque, ospita e
contorna le cellule specifiche di quell’organo: nel fegato saranno gli
epatociti, nel polmone i pneumociti, nel rene i nefrociti, nelle
valvole del cuore i fibrociti, etc.
Il
tessuto connettivo è la rete
di sottili filamenti (fibrille) che fa da impalcatura a tutto il nostro
corpo (figura 1). Infatti, a seconda degli
organi, la rete di tessuto connettivo, presente ovunque, ospita e
contorna le cellule specifiche di quell’organo: nel fegato saranno gli
epatociti, nel polmone i pneumociti, nel rene i nefrociti, nelle
valvole del cuore i fibrociti, etc.
La valvola mitrale è la struttura del nostro corpo, in gran parte composta di tessuto connettivo, sottoposta al maggiore stress meccanico (la pressione prodotta all’interno del cuore), senza pausa. Infatti, essa si muove di continuo, da quando veniamo concepiti nel grembo materno (è quella piccolissima struttura che le mamme, al giorno d’oggi, conoscono bene perché il loro ginecologo, effettuando l’ecografia, la indica come primo indizio di movimento nel corpo del bimbo, che ha cominciato a svilupparsi dentro di loro), fino all’ultimo istante di vita.
Essa si apre e chiude 60-90
volte al minuto, mentre siamo svegli, ma anche quando dormiamo (figura 2). 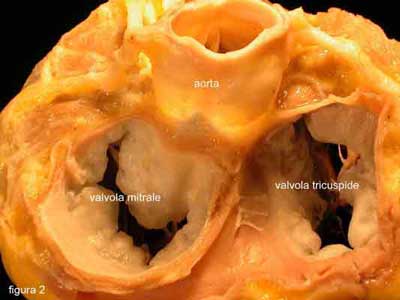
E’ la struttura che si chiude, inoltre, con lo stress maggiore,
determinato dalla pressione di contrazione (sistolica, o massima) prodotta dal nostro cuore
per spingere il sangue, attraverso l’arteria aorta, in tutto il corpo.
La funzione della valvola mitrale è quella di consentire il passaggio del sangue ossigenato, proveniente dai polmoni, all’interno delle camere del cuore e di impedire, allo stesso tempo, che il sangue torni indietro, quando il cuore si contrae per spingerlo in tutto il corpo. E’ quella che gli esperti di meccanica o idraulica chiamerebbero valvola di non ritorno.
Voglio precisare che dire alterazione genetica non significa dire difetto congenito (cioè anomalia già presente alla nascita). Infatti la valvola mitrale funziona normalmente al momento della nascita, ma, successivamente, con una progressione nel tempo tipica e diversa per ogni paziente, si può deformare rigonfiandosi e dilatandosi fino a determinare il caratteristico mancato contatto in chiusura dei due lembi di cui è composta: compare così il reflusso (insufficienza), che determina quel soffio cardiaco che il medico può rilevare auscultando il paziente con il fonendoscopio.
La valvola mitrale, in realtà, non è una struttura unica. Infatti, essa è costituita da un complesso di quattro strutture in connessione fra di loro, unite a loro volta con le pareti muscolari delle cavità cardiache (atrio e ventricolo sinistri).
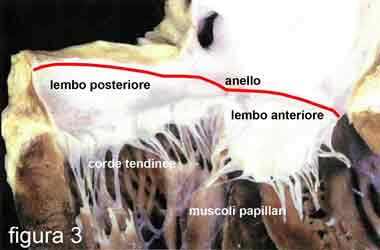
Le quattro componenti sono: l’anello (anulus), i due lembi (anteriore e posteriore), le corde tendinee e i muscoli papillari (figura 3).
Le corde tendinee, analogamente alle stecche dell’ombrello, hanno la funzione di evitare il “rovesciamento” all’indietro dei lembi, che costituiscono i due battenti della valvola, quando la pressione, determinata dalla contrazione cardiaca, li fa chiudere.
L’ anello fibroso, cui i lembi valvolari sono ancorati e che varia la sua forma e dimensione durante il ciclo cardiaco, come uno sfintere (l’insieme di muscoli che circondano un orifizio - ad esempio la bocca e l’ano - e che, dilatandosi e restringendosi alternativamente, lo aprono e lo chiudono), è la struttura che collega i lembi alla parete delle cavità cardiache nel punto di unione fra atrio e ventricolo sinistro, mentre le corde tendinee li ancorano in basso alla parete del ventricolo sinistro, per mezzo di due estroflessioni della parete stessa dette muscoli papillari.
Una genetica debolezza strutturale del tessuto connettivo di tutte queste componenti determina, nel tempo, la progressiva dilatazione dell’anello, l’allungamento delle corde tendinee e l’accrescimento e dilatazione (come un paracadute) dei due lembi.
In questa fase, si assiste alla comparsa di un rigonfiamento a vela (billowing) dei lembi valvolari, anche se questi arrivano ancora a toccarsi, al di sotto del piano di giunzione fra atrio e ventricolo, quando si chiudono, per una estensione sufficiente a mantenere la regolare funzione della valvola.
E’ questa la fase che spesso viene scoperta con l’ecocardiogramma e definita, non proprio correttamente, prolasso della mitrale (figura 4).
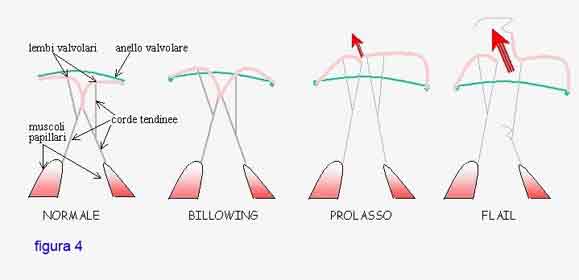
Il vero prolasso, in realtà, è una fase successiva nella quale i due lembi, durante la chiusura, si spostano verso l’alto al di sopra del piano che divide l’atrio dal ventricolo (anulus o anello valvolare), e spesso non arrivano a toccarsi, producendo un grado più o meno severo di insufficienza mitralica (una parte del sangue, già passato nel ventricolo per essere spinto nella circolazione sistemica-generale del corpo, se ne torna indietro attraverso la valvola malfunzionante).
La fase successiva è prodotta dalla rottura delle corde tendinee (flail), che, dopo anni di continuo stiramento, allungamento ed assottigliamento, cedono producendo il rovesciamento all’indietro del lembo durante la chiusura, causando un severo aggravemento dell'insufficienza mitralica (figura 4).
E’ in questo momento che il paziente inizia, più o meno improvvisamente, ad accusare disturbi, come la mancanza di respiro (dispnea) o una sensazione (cardiopalmo) di importante batticuore (all’inizio, solo durante gli sforzi, poi anche a riposo o distendendosi a letto – si aggiungono cuscini), fino all’edema polmonare (inondamento dei polmoni da parte di liquido), che richiede l’immediato ricovero in ospedale.
Come avrete capito, la distinzione fra billowing, prolasso e flail non è una pura classificazione scientifica, ma identifica tre fasi ben distinte della malattia, con implicazioni diverse dal punto di vista della storia naturale e delle decisioni terapeutiche.
Ogni cardiologo o cardiochirurgo dovrebbe usare questi termini in modo corretto, per evitare di dare informazioni non complete e confondenti ai propri pazienti, creando così ingiustificate ansie o pericolosi ritardi nei controlli successivi.
Infatti, osservando la storia naturale, se si effettuasse un esame ecocardiografico di routine, in più del 20% della popolazione si potrebbe riscontrare un billowing (definito spesso nel referto, in modo approssimativo, come “atteggiamento prolassante della valvola mitrale”).
In realtà, solo una parte di queste persone progrediranno, nella loro vita, verso il vero prolasso e, quindi, verso un qualche grado di insufficienza mitralica. Inoltre, fra questi ultimi, solo una parte vedrà aumentare progressivamente il grado di insufficienza, fino alla rottura delle corde tendinee, o fino alla necessità di affrontare un intervento chirurgico. Ma, comunque, la sentenza di “prolasso della mitrale” può creare stati di ansia o insicurezza del tutto infondati, se non si informa adeguatamente il paziente del suo significato.
Andando ora alle implicazioni terapeutiche di questo quadro, variabile nel tempo, possiamo dire che le persone a cui viene riscontrato un semplice billowing, soprattutto se già adulte e senza tendenza familiare ad avere questo tipo di patologia, possono sperare di rientrare nel gruppo di coloro che resteranno in questa situazione per tutta la vita, limitandosi ad effettuare saltuariamente (in base al consiglio del loro Medico di Medicina Generale o Cardiologo di fiducia) un periodico controllo ecocardiografico.
In caso di riscontro di significativo billowing, o ancor di più in caso di vero prolasso, anche se con insufficienza lieve, soprattutto nelle persone giovani, magari con tendenza familiare a questa patologia, i controlli ecocardiografici debbono essere accuratamente programmati. Dopo il primo riscontro, sono consigliabili un paio di controlli dopo 6-12 mesi l’uno dall’altro per valutare la velocità di variazione nel tempo della situazione e, quindi, il programma dei controlli successivi, fino alla indicazione di una valutazione da parte di un Cardiochirurgo per un possibile intervento chirurgico.
In caso di riscontro di rottura di corde tendinee (flail), evidenziata già al primo esame ecocardiografico, questa rappresenta di per sè una indicazione alla chirurgia, considerando il dimostrato incremento di rischio di severe aritmie in questi pazienti. Lo stesso criterio di indicazione alla valutazione di un Cardiochirurgo si deve porre quando compaiono episodi di aritmie, come la fibrillazione atriale, disturbo del ritmo del cuore di cui parlerò fra poco e che il paziente avverte, in genere, come batticuore importante e di lunga durata, cuore che batte in gola, mancanza di battiti cardiaci, etc.
Ora cercherò di descrivere, in
modo molto schematico, la normale circolazione del sangue attraverso la
parte sinistra del cuore (figura 5) e,
successivamente, i mutamenti circolatori
(emodinamici) e le loro conseguenze sui diversi organi, che si
determinano quando compare l’insufficienza valvolare
mitralica.
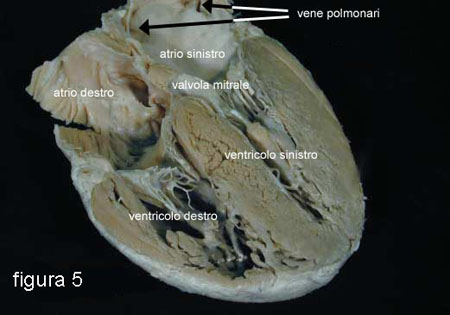
Normalmente, il sangue ossigenato proveniente dai polmoni entra, attraverso le vene polmonari, nella parte del cuore chiamata atrio sinistro.
Da qui, attraverso la valvola mitrale aperta, passa nel ventricolo sinistro, la parte più grossa e potente della pompa cardiaca.
La contrazione del cuore, normalmente, determina:
1. l’apertura della valvola aortica per far passare il sangue, che deve raggiungere e “nutrire” tutto il corpo;
2. la chiusura contemporanea della valvola mitrale per evitare che parte del sangue torni indietro nell’atrio sinistro.
Quando è presente una
insufficienza mitralica, parte del sangue presente nel ventricolo
sinistro viene, al contrario, risospinta indietro nell’atrio sinistro,
attraverso il foro che resta aperto fra i due lembi valvolari mitralici
che non riescono a toccarsi.
Più è significativa l’insufficienza mitralica, maggiore è la quantità di sangue che torna indietro nell’atrio sinistro, come una ”onda anomala” (figura 6).
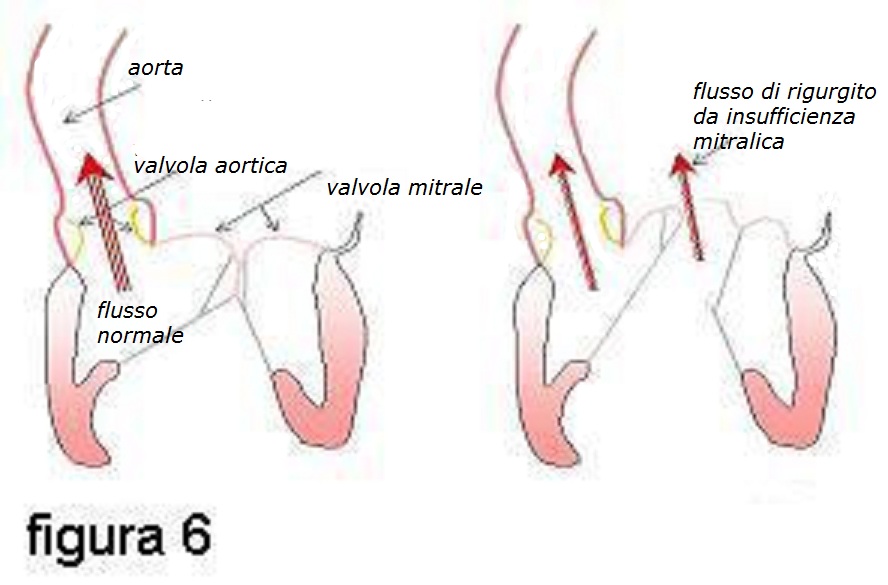
Questo “rigurgito” determina varie conseguenze, nella storia naturale dell’insufficienza mitralica.
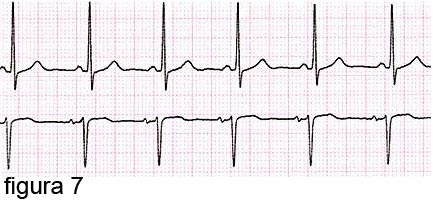
L’atrio sinistro deve far spazio, oltre al sangue normalmente in arrivo dai polmoni, anche a quello che rigurgita dal ventricolo a causa della insufficienza mitralica, aumentando la sua cavità, quindi dilatandosi.
In questa fase l’elettrocardiogramma è sostanzialmente normale (figura 7).
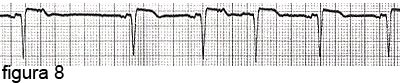
La progressiva dilatazione dell’atrio sinistro comporta la comparsa di irregolarità del ritmo cardiaco (aritmie), manifestando extrasistoli (battiti anomali isolati), in un elettrocardiogramma per il resto normale (figura 8).
Successivamente, si manifestano episodi di fibrillazione atriale (atrio che non si contrae più regolarmente, avendo un movimento “vermicolante” e ventricoli che si contraggono in modo irregolare).
Tali episodi si trasformano,
nel tempo, in fibrillazione atriale permanente
(figura 9) .
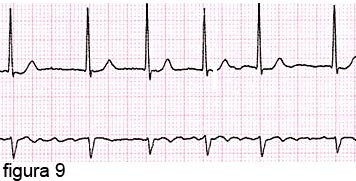
A questo punto il sangue non ha più un flusso regolare fra atrio e ventricolo, ma tende a ristagnare nell’atrio con una reale possibilità che si formino dei coaguli (grumi di sangue non più liquido), che possono venir spinti dal cuore in altri organi (emboli), come il cervello, i reni, gli arti, dando fenomeni molto gravi come l’ictus, le embolie periferiche, l’insufficienza renale, etc.
La dilatazione dell’atrio sinistro e l’aumento della pressione al suo interno, per l’onda di rigurgito, determinano, a loro volta, l’aumento della pressione nella circolazione polmonare, che fatica a scaricare il sangue ossigenato all’interno del cuore. Ciò provoca un ristagno di sangue, quindi di liquidi, nei polmoni e la conseguente difficoltà, più o meno severa, a respirare, nelle fasi iniziali, solo durante gli sforzi, successivamente anche a riposo.
Con l’andar del tempo, o in situazioni particolari, come la rottura improvvisa di più corde tendinee con severo rigurgito di sangue verso l’atrio sinistro e, quindi, dentro ai polmoni, si può arrivare ad una situazione grave come l’edema polmonare (inondamento di liquido nei polmoni), che richiede un immediato ricovero ospedaliero.
A sua volta, anche il ventricolo sinistro deve adeguarsi per pompare, oltre alla normale quantità di sangue necessaria a nutrire tutto il corpo, anche quella quota, più o meno importante (frazione di rigurgito), che va su e giù inutilmente attraverso la valvola mitrale insufficiente. Per un certo periodo, il ventricolo sinistro si adegua aumentando lo spessore della sua parete (ipertrofia). Successivamente, con l’aumento della frazione di rigurgito, anche il ventricolo sinistro finisce la sua riserva e inizia a dilatarsi, con un danno strutturale delle cellule cardiache stesse (fibrosi).
La dilatazione ventricolare provoca una riduzione della capacità di contrarsi del ventricolo stesso, con la conseguente incapacità a pompare una sufficiente quantità di sangue verso il corpo e danno a tutti gli organi periferici (fegato, reni, cervello, intestino, arti, etc.) provocando lo scompenso cardiaco, situazione che mette a rischio la sopravvivenza stessa del paziente. In casi estremi si può giungere ad un quadro detto cardiomiopatia dilatativa che trova, come ultima possibilità terapeutica, solo il trapianto cardiaco, quando esistono le condizioni per indicarlo.
IMPLICAZIONI TERAPEUTICHE
Parlando, ora, delle implicazione terapeutiche, bisogna distinguere tre fasi. Considerando una valvola normale (figura 10):
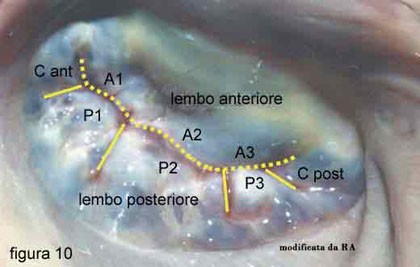
- nella prima fase, quando è presente solo un billowing, come già esposto sopra, non si deve considerare alcuna terapia specifica, né di tipo medico, né, tanto meno, di tipo chirurgico;
- in una seconda fase, quando
compare una insufficienza valvolare mitralica per
prolasso, vanno valutati vari parametri: il grado di
insufficienza, il grado di influenza di questo rigurgito sui vasi che
scaricano il sangue dai polmoni, il grado di dilatazione dell’atrio
sinistro, le dimensioni del ventricolo sinistro,etc. Tutte assieme,
queste valutazioni permettono di stabilire un percorso di controlli e
terapie, fino all’eventuale intervento chirurgico.
La presenza di insufficienza valvolare comporta, in ogni caso, la
necessità di instaurare una terapia medica, sotto il vigile controllo
del Medico di Medicina Generale, del Cardiologo o del Cardiochirurgo di
fiducia, in un rapporto di collaborazione costante, in quanto i farmaci
usati in questa fase migliorano decisamente la situazione clinica, ma
possono mascherare il peggioramento reale della capacità contrattile
del cuore e dell’impegno polmonare. Questi possono venir evidenziati solo
da accertamenti particolari, come l’ecocardiogramma
transesofageo bidimensionale che mostra il
grado di compromissione dell’apparato valvolare, come un flail, o
il color-doppler, che evidenzia il conseguente
grado di rigurgito, o lo stress-test farmacologico (dobutamina) o con
esercizio fisico (exercise stress-test).
Nel caso questi accertamenti dimostrino un significativo danneggiamento
dell’atrio sinistro, del ventricolo sinistro, del circolo polmonare, o
la comparsa, anche saltuaria, di aritmie (fibrillazione atriale
parossistica), è accettato dalle linee guida internazionali che bisogna
procedere verso un intervento chirurgico;
- nella terza fase, quando i primi accertamenti dimostrano già la presenza di un flail non esiste alternativa ad un sollecito intervento chirurgico, pena il rischio di gravi aritmie cardiache e il danneggiamento della funzionalità del cuore in breve tempo.
Delle implicazioni legate al tipo di alterazione della valvola mitrale che consigliano una risoluzione chirurgica più o meno precoce, basate anche sul Cardiochirurgo di riferimento e sulla sua propensione a riparare la valvola mitrale, anziché sostituirla, parleremo successivamente nel capitolo dedicato al trattamento chirurgico dell’insufficienza mitralica. Ugualmente parleremo degli indiscutibili vantaggi della ricostruzione, in mani esperte, della valvola (detta anche plastica o riparazione mitralica), rispetto alla sostituzione della stessa con protesi artificiali meccaniche o biologiche.
Mostrerò, con brevi videoclip, le diverse tecniche di riparazione e, in particolare, quelle da me ideate sperimentalmente ed utilizzate clinicamente dal 1986 e diffuse successivamente a molti cardiochirurghi nel mondo, con risultati a distanza ottimali, dimostrati dai controlli ecocardiografici intra-operatori e dal color-doppler postoperatorio che evidenzia l’assoluta assenza di un rigurgito residuo a distanza negli anni.
