LE TECNICHE
CHIRURGICHE
In questa
sezione, sono disponibili anche filmati reali intraoperatori. Non hanno lo
scopo di fornire alcuna informazione scientifica di tecnica operatoria per i
chirurghi, ma solo di mostrare la consistenza e delicatezza delle strutture
interessate, la molteplicità di manovre e procedure che si debbono mettere in
atto per riparare in modo corretto e duraturo la valvola mitrale. Spero possano
servire anche ai pazienti già operati e, soprattutto, a coloro che dovranno
farlo, per esemplificare quanto a parole talvolta il cardiochirurgo non riesce
ad illustrare in modo comprensibile. Mi piacerebbe che potessero aiutare a
togliere quel velo di mistero che avvolge l’intervento cardiochirurgico…
toccare e fermare il cuore…aprirlo…ripararlo…farlo ripartire…Spero possano
contribuire a rendere più familiare, e quindi sereno, l’approccio del paziente
alle tecniche chirurgiche specifiche di questa patologia.
Dopo
aver concluso la preparazione preoperatoria, inizio con il descrivere quello
che avviene dal risveglio del paziente il mattino del giorno stabilito per
l’intervento.
Descriverò
un tipico esempio di ricostruzione valvolare mitralica in caso di malattia
degenerativa (prolasso). Più avanti illustrerò le caratteristiche dei diversi
interventi, che si effettuano per ricostruire la valvola mitrale in caso di
altri tipi di patologie come, ad esempio, l’infezione
o l’infarto.
Se
l’intervento è previsto per il mattino, gli viene somministrata la
preanestesia. Questa consiste, in genere, nella assunzione di un farmaco, che
riduce lo stato d’ansia e consente al paziente di giungere in sala operatoria
rilassato, talora addirittura assopito. Se l’intervento è previsto nel
pomeriggio, la preanestesia verrà somministrata in tarda mattinata, circa
un’ora prima del trasferimento in sala operatoria.
All’arrivo
in sala operatoria, verrete accolti dagli infermieri professionali di quel
settore, che appresteranno la prima parte del monitoraggio, completato
successivamente dall’anestesista. Questa procedura consiste nell’attivare un
controllo continuo dell’elettrocardiogramma, della pressione arteriosa, della
pressione venosa all’interno del vostro cuore (pressione venosa centrale),
della temperatura corporea superficiale ed interna. Vi verranno inserite alcune
piccole cannule nelle vene per iniettare i farmaci necessari durante
l’intervento.
Vi verrà
effettuata, se in uso nel centro da voi scelto, una procedura che consente di
ridurre il dolore postoperatorio, aiutandovi in una ripresa più veloce e
confortevole: l’anestesia spinale. Consiste nell’iniettare nella schiena, in
prossimità del midollo spinale, a livello del torace, una sostanza che riduce
la percezione del dolore per almeno 24 ore.
A questo
punto verrà indotta l’anestesia: vi saranno somministrati farmaci che vi
faranno addormentare serenamente.
Verrete
quindi intubati: un apposito tubo verrà inserito dalla bocca all’interno della
trachea per consentire l’insuflazione di ossigeno e aria nei polmoni.
Vi verrà
inserita dalla bocca anche la sonda per l’ecocardiografia
transesofagea (TEE). Qualcuno sa già cos’è questo tipo di ecocardiografia e
a che cosa serve, perché vi si è già sottoposto nella preparazione
preoperatoria. Questo esame consente al cardiochirurgo, in sala operatoria, di
visualizzare esattamente la situazione in quel momento, i meccanismi esatti che
provocano l’insufficienza della valvola, le zone interessate, le zone da
rinforzare. Può, inoltre, vedere se esistono altre lesioni cardiache, come
malfunzioni di alte valvole e coesistenza di difetti congeniti, e valutare lo
stato di salute (la funzionalità) del muscolo cardiaco, oltre che le dimensioni
delle cavità del cuore. Tutto questo dà la possibilità al cardiochirurgo di
pianificare nei minimi dettagli le varie procedure e manovre che dovrà
effettuare durante l’intervento, valutando l’estensione della malattia e i
diversi meccanismi che la determinano,
TEE preoperatoria.
e
controllando con il doppler a colori l’entità e la direzione del getto di
rigurgito mitralico.
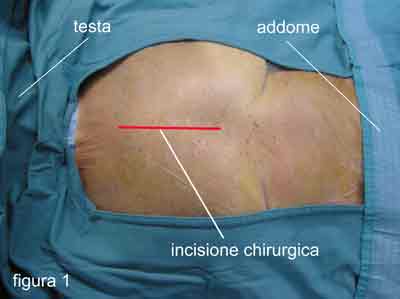
Dopo
aver proceduto ad una disinfezione accurata, ripetuta più volte, di tutte le
parti del corpo che saranno sede di manovre chirurgiche certe o possibili
(torace, parte alta dell’addome, inguini, gambe), si delimita il campo
operatorio con teleria sterile, che lascia esposte solo le zone interessate
dagli accessi chirurgici (figura 1).
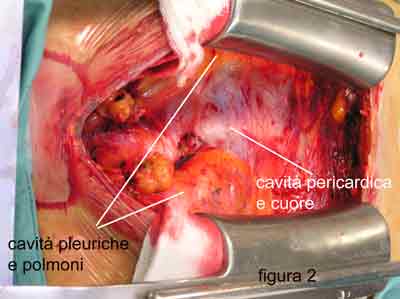
Come ho
affermato anche in altre parti del sito, lo scopo delle mie ricerche e della
loro applicazione clinica è stato sempre quello di cercare di ricostruire nel
modo più naturale (fisiologico) le strutture, normalizzando quindi la funzione,
della valvola mitrale.
Per questo
motivo, ho cercato di trovare il modo di utilizzare il più possibile materiali
autologhi (provenienti dal paziente stesso) per le varie manovre utilizzate
nella ricostruzione. In questa logica, dopo aver esposto il sacco pericardico,
anziché aprirlo semplicemente, come fanno tutti i cardiochirurghi, ne prelevo
una porzione di circa 6/7 x 6/
Successivamente
si mettono in atto tutte le manovre che servono per instaurare  Questa tecnologia, messa a punto nei primi anni ’50 del secolo
scorso, ha aperto le porte del cuore ai cardiochirurghi. Prima, si potevano
effettuare solo procedure sulla superficie del cuore, mentre pulsava regolarmente,
o poche manovre al suo interno, alla cieca, penetrandovi con le dita o con
qualche strumento particolare, attraverso dei fori praticati nelle pareti delle
sue camere.
Questa tecnologia, messa a punto nei primi anni ’50 del secolo
scorso, ha aperto le porte del cuore ai cardiochirurghi. Prima, si potevano
effettuare solo procedure sulla superficie del cuore, mentre pulsava regolarmente,
o poche manovre al suo interno, alla cieca, penetrandovi con le dita o con
qualche strumento particolare, attraverso dei fori praticati nelle pareti delle
sue camere.
Circolazione extracorporea.
di depurare il sangue proveniente dal circolo venoso dalla sostanza da
eliminare raccolta in tutto il corpo (anidride carbonica) e di arricchirlo del
carburante che dovrà distribuire con il circolo arterioso a tutti gli organi
(ossigeno).
Consentitemi, adesso, una piccola digressione storica. I primi ad accorgersi dell’esistenza del cuore, un organo che continuava a muoversi anche dopo la morte del corpo, furono i nostri antenati che abitavano la grotta di El Pindal circa 13.000 anni fa (figura 4).

Per quanto
riguarda la circolazione del sangue, già nel 1242 Ibn
al-Nafis, uno studioso arabo, fra i primi ad effettuare le dissezioni dei
corpi, descrisse la circolazione polmonare, capillare, coronarica (figura 5).
Solo nel 1628 William Harvey descrisse il movimento del sangue nei vasi
sanguigni (figura 6).
Appurato
che le conoscenze in questo campo hanno radici profonde e solide, torniamo alla
macchina cuore-polmone, che ci consente di supplire completamente alle funzioni
del cuore e dei polmoni. Inserendo apposite cannule a livello dell’atrio destro
e dell’aorta, abbiamo la possibilità, così, di by-passare (creare un ponte escludendoli) il
cuore ed i polmoni.
Si attiva
la macchina e, a questo punto, si può isolare il cuore, rendendolo privo di
sangue, dal resto della circolazione occludendo l’aorta, con un apposito
strumento detto clamp (figura 7).

Inizia ora
la parte centrale dell’intervento, nella quale ogni paziente è diverso dagli
altri. Si incide la parete dell’atrio sinistro del cuore per poter mettere in
evidenza le strutture della valvola mitrale dall’alto (figura 8).
Innanzitutto
va effettuata una accurata esplorazione di tutte le componenti della valvola:
anello, lembi, corde tendinee, muscoli papillari, parete ventricolare.
Come ho
descritto nella sezione dedicata alle diverse cause di insufficienza
mitralica, i meccanismi sono diversi in ciascuna di queste e, quindi,
diverse saranno le manovre e le tecniche da utilizzare per effettuare una
ricostruzione efficace e duratura.
La
filosofia che, a mio parere, deve seguire un cardiochirurgo, determinato nel
ricostruire in modo efficace e duraturo il maggior numero di valvole possibili,
è quella di conoscere e saper mettere in atto tutte le differenti tecniche e
manovre messe a punto dai vari ricercatori, individualizzandone, poi,
l’utilizzo a seconda delle caratteristiche del paziente.
Parlando di
un tipico caso di prolasso della valvola mitrale, bisogna valutare il grado di
dilatazione dell’anulus, per poter determinare di quanto si debba
restringere. Si osservano, inoltre, le corde
tendinee per evidenziare se sono allungate, o addirittura rotte, se siano
ispessite o assottigliate al fine di stabilire se, dove e quante corde
artificiali debbano essere applicate. A questo fine, si valutano i muscoli
papillari, che possono variare come numero e distribuzione, per definire i
punti di ancoraggio delle nuove corde tendinee. Vengono, poi, esaminate le 8
componenti che normalmente costituiscono i due lembi
di chiusura della valvola (A1, A2, A3, P1, P2, P3, commissura anteriore e
commissura posteriore). Questi possono essere ridondanti, spessi, con eccesso
di tessuto (degenerazione mixoide), oppure sottilissimi, trasparenti con poco
tessuto (deficienza fibroelastica); possono avere delle fessure profonde fra di
loro; possono avere zone calcificate, immobili….Tutte queste alterazioni
richiedono specifiche manovre e tecniche chirurgiche di correzione.
Al termine di questa complessa valutazione viene stabilita la strategia e la successione delle diverse tecniche che debbono venir utilizzate per correggere in modo efficace e duraturo tutte le alterazioni evidenziate.
Una volta
definita la strategia chirurgica, si procede ad eseguire le manovre previste,
iniziando da quelle che tolgono, riducono il tessuto valvolare per ottenere una
visuale più ampia del campo operatorio. Se si è deciso di agire anche sul lembo
posteriore, generalmente, al giorno d’oggi, fra le tecniche tradizionalmente
utilizzate, resta la resezione quadrangolare, associando o meno la riduzione
dell’altezza, di questo lembo (sliding quadrantectomy).
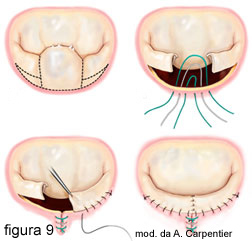 Questa
procedura consiste nell’asportare la parte prolassante del lembo posteriore,
suturando fra di loro i due monconi restanti (figura 9) e, se necessario,
abbassando la loro altezza, affinché non si determini un meccanismo di chiusura
della valvola inadeguato (SAM = systolic anterior motion), argomento di
interesse specialistico che, quindi, non approfondirò in questa sede. In ogni
caso, questa tecnica richiede esperienza nella valutazione e un tempo
chirurgico aggiuntivo di ischemia cardiaca non trascurabile.
Questa
procedura consiste nell’asportare la parte prolassante del lembo posteriore,
suturando fra di loro i due monconi restanti (figura 9) e, se necessario,
abbassando la loro altezza, affinché non si determini un meccanismo di chiusura
della valvola inadeguato (SAM = systolic anterior motion), argomento di
interesse specialistico che, quindi, non approfondirò in questa sede. In ogni
caso, questa tecnica richiede esperienza nella valutazione e un tempo
chirurgico aggiuntivo di ischemia cardiaca non trascurabile.
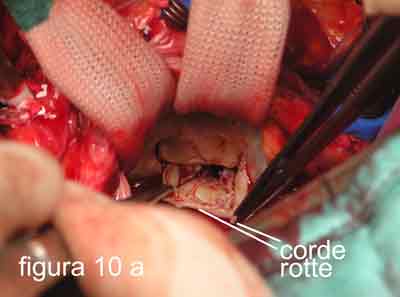
Personalmente, avendo introdotto nell’esperienza clinica umana in Italia la tecnica di applicazione di corde tendinee artificiali nel 1986, dopo 2 anni di lavoro sperimentale negli Stati Uniti, da più di 10 anni utilizzo un approccio diverso, a mio parere, più semplice e veloce, nella maggior parte di questi casi. Infatti, mi limito ad asportare il margine libero del lembo posteriore (figure 10 a-b-c), dove si inseriscono le corde artificiali allungate o rotte, riducendone l’altezza a quanto ritenuto utile per evitare il SAM. Il nuovo margine libero verrà supportato da corde artificiali che consentiranno di regolare la profondità di chiusura del lembo posteriore nei confronti del lembo anteriore.
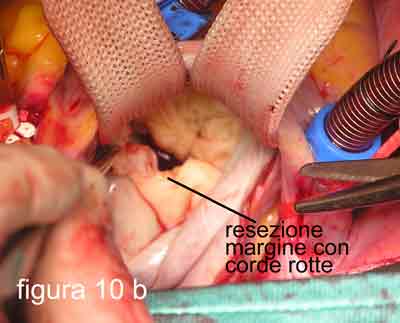
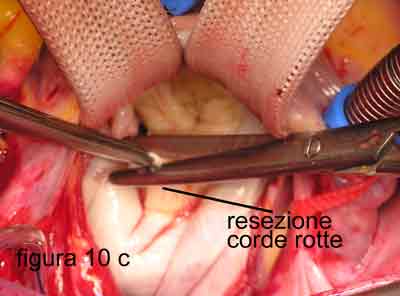
A
prescindere dalla tecnica applicata a livello del lembo posteriore, a questo
punto, si debbono inserire le corde artificiali, che dovranno sostenere tutte
le aree dei lembi valvolari prive di supporto (corde rotte o allungate), o con
supporto affidato a corde alterate (ispessite o assottigliate), che nel futuro
potrebbero determinare la progressione della malattia con ricomparsa dell’insufficienza
valvolare.
La tecnica
di applicazione di corde tendinee artificiali, negli anni, dopo la nostra
introduzione clinica nel
Personalmente,
dopo circa 25 anni di utilizzo (sperimentale e clinico), ritengo di dover
proseguire ad adottare sempre la stessa metodica, che mi ha concesso di
ottenere risultati ottimali e riproducibili da parte di tutti i
cardiochirurghi, che hanno seguito i miei suggerimenti. Ovviamente, come per
ogni procedura chirurgica, sono sempre aperto a qualsiasi contributo possa
rendere più semplice, efficace ed efficiente la tecnica di utilizzo. Sto
collaborando, infatti, con altri cardiochirurghi che propongono di utilizzare
diverse metodiche per rendere ancora più semplice e, quindi, utilizzabile anche
da chirurghi con minore esperienza, l’applicazione delle corde artificiali.
Descriverò,
a questo punto, le varie fasi di applicazione delle corde artificiali in
Gore-Tex®, da me messa a punto sperimentalmente nel 1985, presso i laboratori
dell’Albert Einstein College of Medicine di New York. Sono dettagli che
potrebbero interessare più gli “addetti ai lavori”, i cardiochirurghi, che i
pazienti. D’altra parte, nella mia esperienza clinica, da tempo numerosi
pazienti mi chiedono dettagli precisi sulla tecnica chirurgica e alcuni mi
hanno chiesto di poter avere anche un breve video-clip sulla metodica, per
riguardarla a casa. D’ora in poi, questa curiosità potrà trovare risposta in
questo sito.
La prima
fase consiste nell’ancorare quelle che saranno le future corde tendinee
artificiali ai muscoli papillari, nei punti da cui originano quelle naturali
alterate o rotte (posizione ortotopica). Vengono utilizzati filamenti in
Gore-Tex® di diametro molto sottile (5-0) in modo che la nuova corda
artificiale, una volta ricoperta dal tessuto del paziente, che crescerà sia dal
lato del muscolo papillare che da quello del lembo, avrà una dimensione
assolutamente sovrapponibile a quella delle corde naturali, ma con una
resistenza allo stress 10 volte superiore rispetto a queste.
Al fine di evitare problemi per la stabilità dell’ancoraggio, io continuo a rinforzarlo con dei piccoli frammenti (pledget) di pericardio del paziente, per evitare quanto mi ha personalmente segnalato il professor Tirone David, che per primo ha utilizzato la tecnica delle corde artificiali, dopo i miei risultati sperimentali.
Se
non si rinforza l’ancoraggio a livello del muscolo papillare, ad esempio
con un pledget di pericardio autologo,
sono stati
riportati casi di rottura del muscolo con disancoraggio delle corde artificiali.
Dopo aver
fissato ai papillari tutte le corde artificiali previste, si procede alla
ricostruzione delle eventuali resezioni effettuate sui lembi valvolari e alla
chiusura delle discontinuità di tessuto (schisi o indentazioni) che
spesso si riscontrano in queste valvole patologiche. In questo modo si dispone
dei lembi ricostruiti in modo definitivo e le corde artificiali potranno essere
ancorate a loro nella posizione più corretta.
Nella
seconda fase si fissano i capi delle corde artificiali al margine libero dei
lembi. Anche a questo livello, esistono vari metodi utilizzati da diversi
chirurghi. Io, da sempre, utilizzo un doppio passaggio nel tessuto del lembo
per creare un attrito che consentirà di effettuare i test finali (vedi terza
fase) senza alterare la lunghezza prestabilita delle corde artificiali.
Questo
particolare tecnico si è dimostrato un elemento cruciale per il successo
dell’intervento.
Dopo
aver ancorato tutte le nuove corde ai lembi valvolari, si effettua la manovra
di riduzione del diametro dell’anulus valvolare (anuloplastica). E’ una manovra
indispensabile. E’, infatti, inequivocabilmente dimostrato che qualsiasi
tecnica utilizzata per ricostruire una valvola mitrale degenerata, non potrà
avere un risultato positivo a lungo termine se non viene ristabilita e fissata
la dimensione corretta del suo anulus.
Fin dal
maggio 1988 (più di 21 anni di esperienza) utilizzo solo il pericardio, nella
quasi totalità dei casi, del paziente (autologo), preparato come ho descritto
sopra.
Questo vale per tutti i casi di malattia degenerativa o infettiva della valvola, mentre, in caso di insufficienza mitralica di origine ischemica o da cardiomiopatia dilatativa, applico anelli protesici (figura 11).

Ovviamente,
anche per questa manovra, è fondamentale rispettare alcuni precetti ineludibili
(di interesse assolutamente specialistico) sulla dimensione e sulla corretta
zona di ancoraggio della fettuccia di pericardio, o di ogni altro tipo di
anello artificiale.
E’ il momento della terza fase di applicazione delle corde artificiali, la più
critica per ottenere un risultato positivi immediato e duraturo nel tempo:
determinare la lunghezza corretta delle varie corde artificiali predisposte. Lo
scopo è quello di far combaciare i margini dei due lembi, all’interno del
ventricolo sinistro, per evitare l’insufficienza.
Per ottenere
questo risultato, dopo aver avvicinato i lembi nella probabile posizione
corretta,
Lunghezza corde artificiali
si
gonfia il ventricolo sinistro con una soluzione idonea (test idrodinamico) per
far combaciare i lembi della valvola e valutare se la chiusura avviene in
modo corretto, o se persistono punti di scarso contatto e, quindi, di
persistenza dell’insufficienza.
Utilizzando
la mia metodica, a questo punto esiste ancora la possibilità di modificare la
lunghezza delle nuove corde artificiali, in modo da ottenere un risultato
ottimale.
Solo a
questo punto si passa alla fissazione definitiva delle corde, legando i due
filamenti che le compongono con una tecnica ben precisa, che richiede esperienza,
per evitare di alterarne la lunghezza prestabilita.
Un test
idrodinamico finale conferma la correttezza della riparazione effettuata.
Prova idrodinamica finale
Si procede quindi alla sutura dell’atrio sinistro, all’apertura dello strumento
che aveva isolato il cuore dal resto della circolazione (clamp), ripristinando,
quindi, il flusso di sangue nelle arterie coronarie e consentendo al cuore di
riprendere la sua attività elettrica e meccanica, spontaneamente o con una
scossa elettrica. Lentamente si svezza il cuore dalla circolazione
extracorporea (CEC), ripristinando anche la ventilazione dei polmoni.
A
questo punto, il controllo ecocardiografico intraesofageo (TEE), può dare la
garanzia del successo della ricostruzione sia come apposizione corretta dei
lembi.
che come
assenza di insufficienza residua. Nei rarissimi casi in cui il risultato non è
ottimale, si determina, con il cuore in movimento, il meccanismo che provoca
l’imperfezione della ricostruzione e si procede ad una ulteriore correzione.
Alla fine vengono rimosse tutte le cannule che erano state inserite per
effettuare la circolazione extracorporea e si procede alla chiusura del torace
del paziente, lasciando uno o più tubi di drenaggio. Questi escono al di sotto
della ferita chirurgica e consentono la fuoruscita delle secrezioni che si
formano nelle prime ore. Inoltre vengono applicati due sottili filamenti elettrici
che, collegati ad un pace-maker provvisorio esterno, potranno venir utilizzati
per modulare la frequenza dei battiti cardiaci, a seconda delle necessità,
nelle prime giornate dopo l’intervento. I tubi di drenaggio vengono rimossi, in
genere, dopo un paio di giorni dall’intervento. I filamenti del pace-maker
vengono asportati prima della dimissione dall’ospedale.
La tecnica che ho appena descritto, l’applicazione di corde tendinee
artificiali, può essere utilizzata, in talune situazioni, anche in occasione di
reintervento, in caso di recidiva di insufficienza mitralica, dopo un primo
intervento effettuato con altre metodiche.
Riporto
qui, solo come esempio, il caso di un paziente operato con la tecnica del
doppio orifizio, presso un’altra struttura. Dopo circa tre mesi
dall’intervento, è ricomparsa un’insufficienza mitralica che si è
progressivamente aggravata, provocando una ulteriore dilatazione dell’atrio
sinistro e la comparsa di aritmie.
Il paziente
è giunto alla mia osservazione ed ho proceduto al reintervento. Dopo aver
asportato l’anello protesico, ancorato non correttamente all’anulus mitralico,
ed aver separato i due lembi, che erano stati suturati fra di loro per generare
il doppio orifizio, ho asportato il tessuto fibrotico che si era formato in
sede di sutura. Ho applicato corde tendinee artificiali, con la consueta
metodica, per riportare i lembi prolassanti nella corretta posizione. Un nuovo
anello protesico è stato collocato per stabilizzare la riparazione.
L’esame
ecocardiografico intraoperatorio ha dimostrato una perfetta continenza della
valvola mitrale.
Anche i
controlli a distanza (oltre 3 anni) hanno mostrato assenza di insufficienza
mitralica.
