Quando la causa dell’insufficienza non è la degenerazione di origine genetica, ma una infezione, che, originatasi in altre parti del corpo (denti, manovre del dentista senza appropriata profilassi antibiotica, apparato uro-genitale, apparato intestinale, ferite non curate adeguatamente, tossicodipendenza con droghe iniettabili nelle vene, etc.) entra nel circolo sanguigno, andando ad attaccare le strutture valvolari del cuore, questo può determinare quadri completamente diversi.
Ricordo nuovamente che la responsabilità di questa malattia va ricercata solo nei batteri e nei funghi , cioè in quei microrganismi che, normalmente, provocano infezioni caratterizzate dalla produzione di secrezioni (pus o catarro) a livello delle vie aeree (gola, tonsille, naso, orecchio, polmoni) o dell’apparato urinario. Gli stessi “normalmente abitano” sulle nostre mucose (alcuni batteri o i funghi come la candida albicans) o sulle pelle ma, entrando nel sangue per manovre mediche o per ferite non trattate, possono attaccare le valvole cardiache. Tutto questo non avviene in caso di infezione da virus. Questi ultimi, infatti, non producono un processo infettivo a livello delle valvole del cuore, ma si limitano ad attaccare le vie respiratorie o altro, come la pelle o gli organi linfatici (es. raffreddore, influenza, morbillo, varicella, rosolia, etc.). In rarissimi casi, i virus possono intaccare il muscolo cardiaco (es. la miocardite acuta in corso di influenza) ma questo problema esula da questo argomento.

In caso di endocardite batterica, i germi responsabili vanno ad annidarsi nelle diverse strutture della valvola provocando la formazione di agglomerati di batteri (figura 1), ed elementi del sangue (vegetazioni) o perforando con i loro enzimi i lembi valvolare.
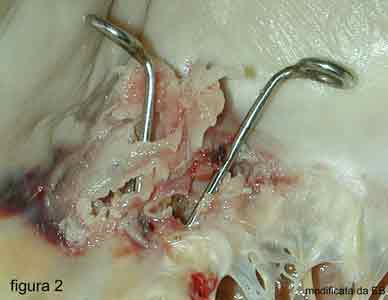
In entrambi i casi dando origine ad una insufficienza valvolare (figura 2).
Questo processo, se diagnosticato per tempo, può essere controllato sufficientemente con una appropriata terapia antibiotica, specificamente mirata a combattere il tipo di germe (batterio o fungo) responsabile. Tale terapia può essere effettuata solo dopo aver identificato, nel sangue del paziente, il tipo esatto di germe responsabile, in quanto alcune famiglie di batteri si sono selezionate e sono diventate resistenti ai comuni antibiotici. Ciò è stato causato anche dall’incauto utilizzo, troppo esteso, di questi farmaci, che la comunità medica ha praticato per trattare anche patologie che non richiederebbero l’uso di antibiotici, o utilizzando antibiotici di classe troppo innovativa ed avanzata, per infezioni banali (abbiamo sparato la bomba atomica per uccidere un topolino…). Ciò ha determinato la scomparsa dei germi meno aggressivi, selezionando solo i più aggressivi e resistenti alle bombe atomiche degli antibiotici.
Molto spesso, se il processo diagnostico e terapeutico si realizza precocemente in modo corretto, coinvolgendo tutte le professionalità necessarie, dal Medico di Medicina Generale, al Cardiologo, allo Specialista di Malattie Infettive, al Cardiochirurgo, la terapia verrà impostata razionalmente, in base alle più recenti evidenze scientifiche e potrà dare un esito positivo in molti casi. Infatti, in un gran numero di casi, una endocardite batterica, correttamente diagnosticata e trattata, non necessiterà di un intervento chirurgico.
Se, sfortunatamente, qualcuno di questi passaggi non si svolgerà in modo corretto, il risultato non sarà soddisfacente richiedendo, alla fine, un intervento cardiochirurgico in elezione (senza alcuna urgenza) o con criterio di urgenza.
Limitandoci alla valvola mitrale, che è il centro di questa analisi, ci possiamo trovare di fronte a diverse situazioni:
a) l’endocardite batterica controllata e risolta dalla terapia antibiotica senza danni funzionali alla valvola;
b) l’endocardite batterica controllata e risolta dalla terapia antibiotica con danni rilevanti alla valvola;
c) l’endocardite batterica non controllabile dalla terapia antibiotica con danni alla valvola e/o episodi di embolia settica e/o episodi di scompenso cardiaco.
Questi quadri clinici rappresentano 3 situazioni assolutamente diverse.
Nel caso (a) sarà sufficiente scoprire quale esposizione al rischio o quale situazione clinica o manovra diagnostica o terapeutica può aver verosimilmente causato l’entrata nel circolo sanguigno dei germi, determinando l’endocardite, e mettere a punto le strategie affinché ciò non possa ripetersi. Fondamentale sarà rendere informato in modo chiaro e approfondito il paziente sulle norme di profilassi di questa infezione, soprattutto se è portatore di una malformazione delle cavità cardiache o di una malfunzione di una valvola.
Nel caso (b) si dovrà seguire nel tempo, con esami ecocardiografici seriati concordati con il proprio cardiologo o cardiochirurgo di fiducia, l’evoluzione del danno provocato dall’infezione, ora guarita, per poter intervenire chirurgicamente, quando ciò dovesse apparire opportuno.
Nel caso (c), dopo aver constatato che il trattamento antibiotico non potrà risolvere l’aggressione dei germi, in quanto persistono i sintomi di una infezione attiva (febbre, elevazione del numero di globuli bianchi nel sangue o, ancor peggio, episodi di embolia di frammenti divegetazioni endocarditiche nel circolo sanguigno periferico – braccia, gambe, cervello, reni, fegato, milza, etc.) bisogna procedere ad un sollecito intervento cardiochirurgico per estirpare l’infezione e porre rimedio ai danni provocati dalla stessa.
Considerando che nel caso (a) non esiste alcuna indicazione alla chirurgia, nel caso (b), invece, si dovrà seguire il paziente nel tempo, per valutare se il danno generato dall’infezione ha provocato una malfunzione della valvola di tipo evolutivo, che farà porre l’indicazione ad una correzione chirurgica. Ci troviamo, in una situazione di infezione spenta, ma con un danno residuo significativo, in un quadro simile a quello determinato dalla malattia degenerativa.
Ci troveremo, infatti, di fronte ad una insufficienza mitralica severa determinata da danni come la rottura di corde tendinee, simili a quelle dovute alla malattia degenerativa.
TEE preoperatoria rottura corde endocardite
Analogamente, pertanto, dovremo cercare di effettuare un intervento di ricostruzione valvolare simile a quello già descritto per l’insufficienza da causa degenerativa, per ristabilire uno stato fisiologico.
In questi casi, infatti, la situazione più frequente è rappresentata dalla rottura di corde tendinee con flail di un lembo. Si tratta di valutare se, oltre al flail di un lembo, provocato dall’infezione, preesista una alterazione genetica (prolasso) della valvola mitrale. In questo caso, la correzione della rottura cordale infettiva va associata alla ricostruzione della malattia di base della valvola mitrale.
Ricostruzione endocardite
L’applicazione, anche in questo caso, di corde artificiali consente di ottenere un risultato ottimale.
TEE postoperatoria
Per le relative tecniche chirurgiche vi rimando, quindi al capitolo dedicato al trattamento chirurgico dell’insufficienza mitralica di tipo degenerativo.
Passando alla situazione clinica di tipo (c), infezione attiva, in passato, e ancora oggi nei centri meno aggiornati ed aggressivi, si preferisce sostituire la valvola con una protesi artificiale.
Innanzitutto, è fondamentale riconoscere se esiste l’indicazione all’intervento. Nella situazione clinica di un processo infettivo che non si riesce a spegnere con la terapia antibiotica, l’esame ecocardiografico bidimensionale ci evidenzierà se esiste una insufficienza significativa.
TEE 2-D preoperatoria endocardite
Nel
caso di incertezza sulla gravità del danno, si potrà utilizzare
l’ecocardiografia in 3 dimensioni (3-D echo), per evidenziare la sede
TEE 3-D asse corto
e il meccanismo dell’insufficienza.
TEE 3-D asse lungo
Una volta definita l’indicazione all’intervento, si deve stabilire la tecnica da utilizzare.
I risultati scientifici pubblicati negli ultimi anni hanno confermato che, anche in caso, e soprattutto, di infezione attiva, la possibilità di conservare la valvola naturale riduce il rischio di progressione o recidiva dell’infezione, rispetto all’utilizzo di materiali artificiali, come un anello protesico per anuloplastica o, ancor peggio, una protesi valvolare artificiale. Questo è dimostrato purché si rispetti il principio fondamentale e imprescindibile della chirurgia in caso di infezione attiva.
Vale, infatti, lo stesso comandamento che rappresenta il cardine della chirurgia dei tumori: la radicalità.
Nel
caso di infezione attiva (batteri ancora presenti e vitali per
inefficacia della terapia antibiotica) è fondamentale, infatti,
asportare tutto il tessuto cardiaco interessato dall’infezione,
risparmiando solo quello sano.
Intervento endocardite attiva 1
Successivamente,
si dovrà valutare come ricostruire la valvola, applicando corde
tendinee artificiali nelle zone rimaste senza supporto
sottovalvolare,
Intervento endocardite attiva 2
ricostruendo la continuità dei lembi valvolari. Ciò si può ottenere facendo "slittare" (sliding) il tessuto rimanente.
Intervento endocardite attiva 3
Nel
caso in cui la resezione del tessuto sia troppo vasta, si può
utilizzare il pericardio stabilizzato del paziente, o quello
commercialmente disponibile di suino, bovino o equino, per ricostruire
la superficie dei lembi.
Se ritenuto necessario, si effettuerà una anuloplastica,
Intervento endocardite attiva 4
per stabilizzare la struttura valvolare, con tessuto autologo (pericardio del paziente fissato in glutaraldeide).
Al termine dell’intervento, in ogni caso, si deve ottenere una corretta apposizione del tessuto valvolare, senza insufficienza residua.
TEE controllo postoperatorio
Il
paziente descritto nei filmati di questo capitolo non ha avuto
complicanze postoperatorie e gode di buona salute dopo più di 5 anni
dall’intervento.
